\( \mathrm{Cl^-} \) (HCl)で沈殿する陽イオン
- \( \mathrm{\mathbf{Ag^+} + Cl^- \longrightarrow AgCl(白色)} \downarrow \)
- \( \mathrm{\mathbf{Pb^{2+}} + 2Cl^- \longrightarrow PbCl_2(白色)} \downarrow \)
- \( \mathrm{\mathbf{Hg_2^{2+}} + 2Cl^- \longrightarrow Hg_2Cl_2(白色)} \downarrow \)
\( \mathrm{S^{2-}} \) (H2S)で沈殿する陽イオン
酸性でも(中性~アルカリ性ではもちろん) \( \mathrm{H_2S} \) で沈殿する陽イオン
- \( \mathrm{\mathbf{2Ag^+} + S^{2-} \longrightarrow Ag_S(黒色)} \downarrow \)
- \( \mathrm{\mathbf{Pb^{2+}} + S^{2-} \longrightarrow PbS(黒色)} \downarrow \)
- \( \mathrm{\mathbf{Hg^{2+}} + S^{2-} \longrightarrow HgS(黒色)} \downarrow \)
- \( \mathrm{\mathbf{Cu^{2+}} + S^{2-} \longrightarrow CuS(黒色)} \downarrow \)
- \( \mathrm{\mathbf{Cd^{2+}} + S^{2-} \longrightarrow CdS(黄色)} \downarrow \)
- \( \mathrm{\mathbf{Sn^{2+}} + S^{2-} \longrightarrow SnS(褐色)} \downarrow \)
- \( \mathrm{\mathbf{Sn^{4+}} + 2S^{2-} \longrightarrow SnS_2(黄色)} \downarrow \)
中性~アルカリ性のとき \( \mathrm{H_S} \) で沈殿する陽イオン
- \( \mathrm{\mathbf{Zn^{2+}} + S^{2-} \longrightarrow ZnS(白色)} \downarrow \)
- \( \mathrm{\mathbf{Co^{2+}} + S^{2-} \longrightarrow CoS(黒色)} \downarrow \)
- \( \mathrm{\mathbf{Ni^{2+}} + S^{2-} \longrightarrow NiS(黒色)} \downarrow \)
- \( \mathrm{\mathbf{Fe^{2+}} + S^{2-} \longrightarrow FeS(黒色)} \downarrow \)
- \( \mathrm{\mathbf{Mn^{2+}} + S^{2-} \longrightarrow MnS(桃色)} \downarrow \)
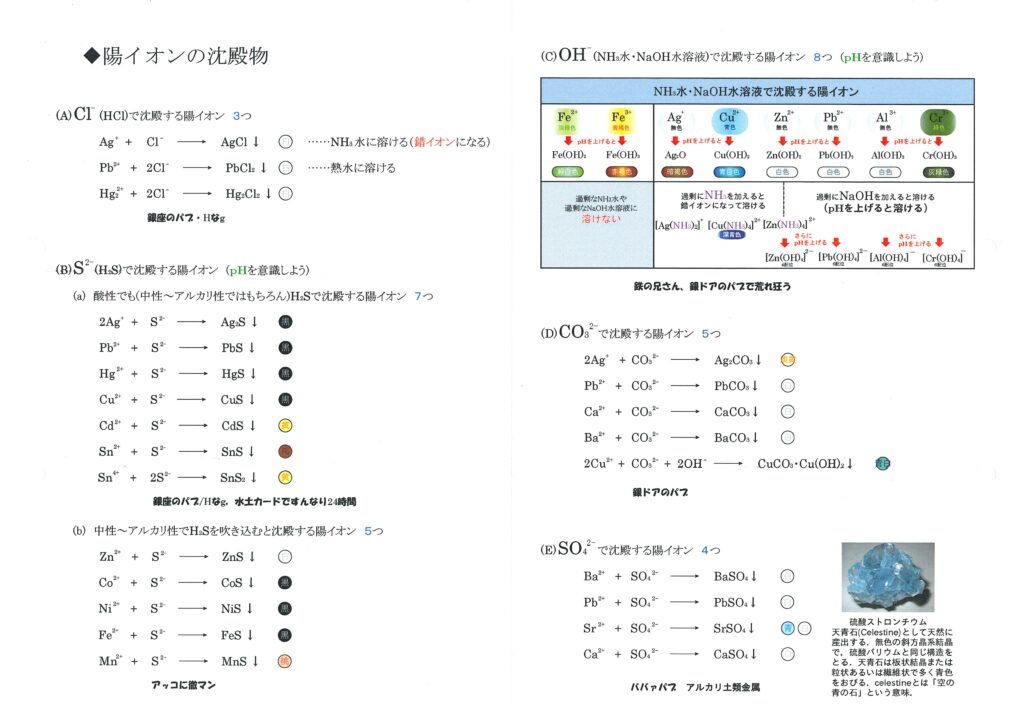
\( \mathrm{OH^-} \) (NaOH水溶液,NH3水)で沈殿する陽イオン
- \( \mathrm{\mathbf{2Ag^+} + 2OH^- \longrightarrow Ag_2O(暗褐色) \downarrow + H_2O} \)
\( \mathrm{Ag_2O} \) にNH3水を過剰に加えると \( \mathrm{[Ag(NH_3)_2]^+} \) となり溶ける。 - \( \mathrm{\mathbf{Cu^{2+}} + 2OH^- \longrightarrow Cu(OH)_2(青白色)} \downarrow \)
\( \mathrm{Cu(OH)_2} \) にNH3水を過剰に加えると \( \mathrm{[Cu(NH_3)_4]^{2+}} \) となり溶ける。 - \( \mathrm{\mathbf{Zn^{2+}} + 2OH^- \longrightarrow Zn(OH)_2(白色)} \downarrow \)
\( \mathrm{Zn(OH)_2} \) にNH3水を過剰に加えると \( \mathrm{[Zn(NH_3)_4]^{2+}} \) となり溶ける。
\( \mathrm{Cu(OH)_2} \) にNaOH水を過剰に加えると \( \mathrm{[Cu(OH)_4]^{2-}} \) となり溶ける。 - \( \mathrm{\mathbf{Pb^{2+}} + 2OH^- \longrightarrow Pb(OH)_2(白色)} \downarrow \)
\( \mathrm{Pb(OH)_2} \) にNaOH水を過剰に加えると \( \mathrm{[Pb(OH)_4]^{2-}} \) となり溶ける。 - \( \mathrm{\mathbf{Al^{3+}} + 3OH^- \longrightarrow Al(OH)_3(白色)} \downarrow \)
\( \mathrm{Al(OH)_3} \) にNaOH水を過剰に加えると \( \mathrm{[Al(OH)_4]^-} \) となり溶ける。 - \( \mathrm{\mathbf{Cr^{3+}} + 3OH^- \longrightarrow Cr(OH)_3(灰緑色)} \downarrow \)
\( \mathrm{Cr(OH)_3} \) にNaOH水を過剰に加えると \( \mathrm{[Cr(OH)_4]^-} \) となり溶ける。 - \( \mathrm{\mathbf{Fe^{2+}} + 2OH^- \longrightarrow Fe(OH)_2(緑白色)} \downarrow \)
- \( \mathrm{\mathbf{Fe^{3+}} + 3OH^- \longrightarrow Fe(OH)_3(赤褐色)} \downarrow \)
あわせて読みたい
\( \mathrm{CO_3^{2-}} \) で沈殿する陽イオン
- \( \mathrm{\mathbf{2Ag^+} + CO_3^{2-} \longrightarrow Ag_2CO_3(淡黄色)} \downarrow \)
- \( \mathrm{\mathbf{Pb^{2+}} + CO_3^{2-} \longrightarrow PbCO_3(白色)} \downarrow \)
- \( \mathrm{\mathbf{Ca^{2+}} + CO_3^{2-} \longrightarrow CaCO_3(白色)} \downarrow \)
- \( \mathrm{\mathbf{Ba^{2+}} + CO_3^{2-} \longrightarrow BaCO_3(白色)} \downarrow \)
- \( \mathrm{\mathbf{2Cu^{2+}} + CO_3^{2-} + 2OH^- \longrightarrow CuCO_3・Cu(OH)_2(青白色)} \downarrow \)
\( \mathrm{SO_4^{2-}} \) で沈殿する陽イオン
- \( \mathrm{\mathbf{Ba^{2+}} + SO_4^{2-} \longrightarrow BaSO_4(白色)} \downarrow \)
- \( \mathrm{\mathbf{Pb^{2+}} + SO_4^{2-} \longrightarrow PbSO_4(白色)} \downarrow \)
- \( \mathrm{\mathbf{Sr^{2+}} + SO_4^{2-} \longrightarrow SrSO_4(青色)} \downarrow \)
- \( \mathrm{\mathbf{Ca^{2+}} + SO_4^{2-} \longrightarrow CaSO_4(白色)} \downarrow \)
